Seleccione si es comprador o proveedor para encontrar recursos y artículos adaptados a sus necesidades.
Comprender la información sobre biocompatibilidad en la página de un producto
Explicación del etiquetado de productos sanitarios, clases de riesgo y procedimientos de aprobación
Al seleccionar biomateriales o dispositivos médicos, es fundamental comprender la información sobre biocompatibilidad proporcionada en la página del producto. Estos datos ayudan a evaluar si un producto cumple con los requisitos de seguridad, normativos y funcionales para aplicaciones médicas. A continuación, se detalla cómo interpretar las secciones clave relacionadas con la biocompatibilidad en una página de producto.
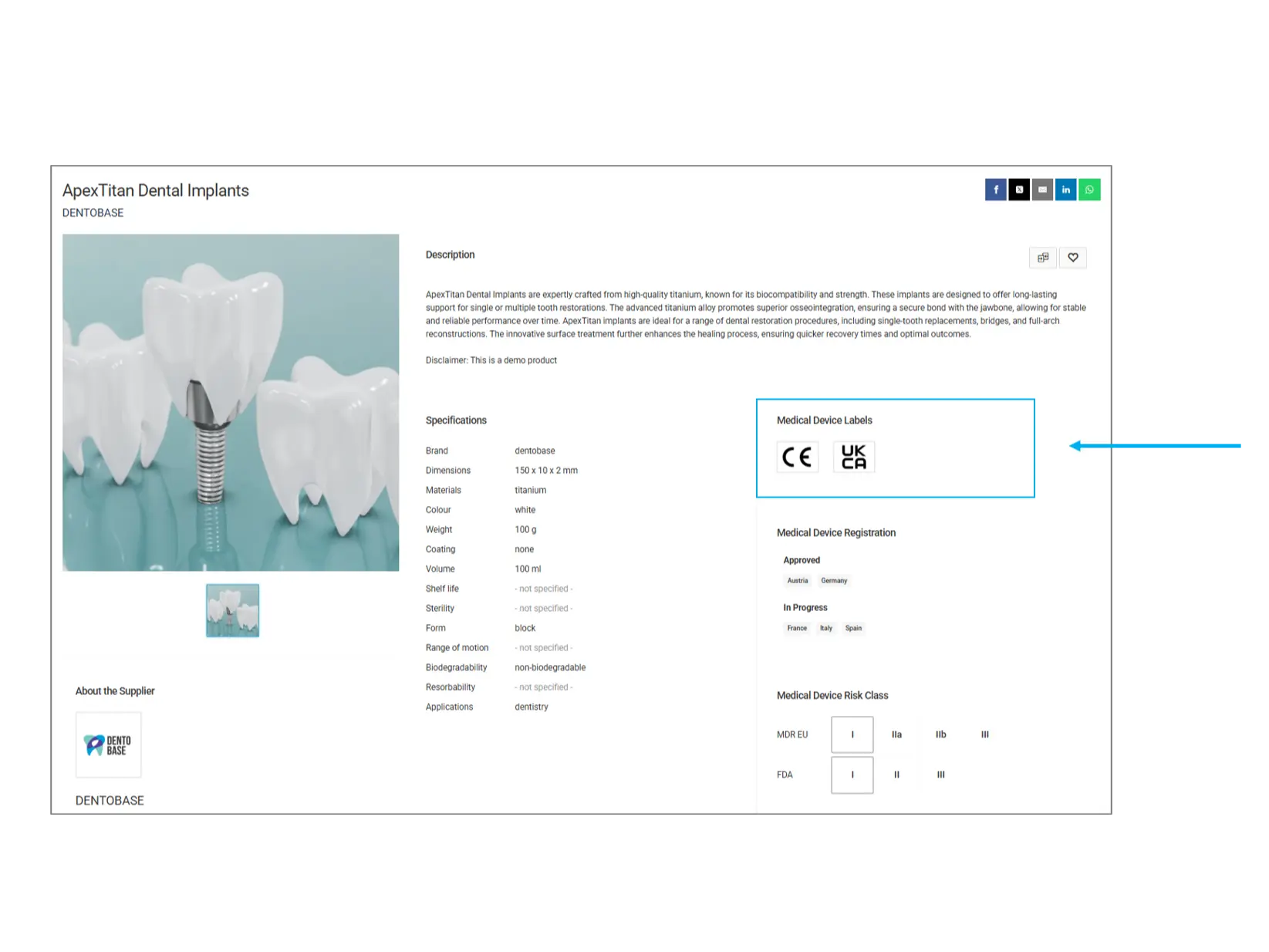
Etiquetas de dispositivos médicos
Las etiquetas de dispositivos médicos indican los estándares normativos y certificaciones que cumple un producto. Estas etiquetas garantizan que el producto cumple con las normativas de seguridad y calidad necesarias.
CE (Conformité Européenne): Indica que el producto cumple con los estándares de seguridad, salud y protección ambiental de la UE.
UKCA (United Kingdom Conformity Assessed): Certificación para productos vendidos en el Reino Unido, asegurando el cumplimiento de la normativa británica.
Otras etiquetas: Puede haber certificaciones adicionales como FDA, ISO u otras aprobaciones específicas de cada país.
¿Qué debes verificar? Asegúrate de que el producto tenga las certificaciones necesarias según los requisitos normativos de tu país.
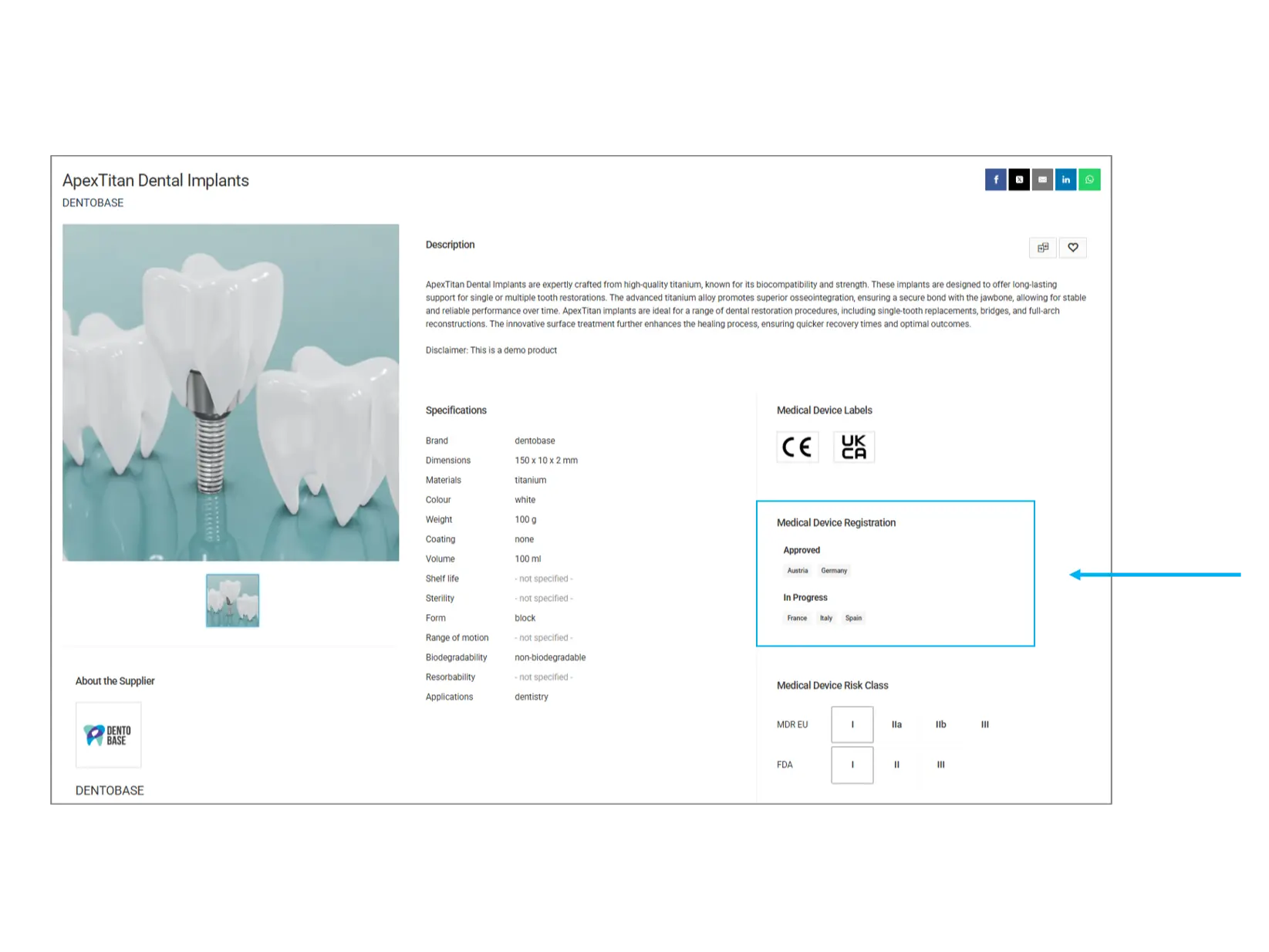
Registro del dispositivo médico
Esta sección proporciona información sobre el estado de aprobación regulatoria del producto en diferentes países.
Países aprobados: El producto ha sido registrado oficialmente y puede comercializarse en estas regiones.
En proceso: El producto está en proceso de evaluación regulatoria y aún no ha sido completamente aprobado en los países mencionados.
¿Qué debes verificar? Si necesitas el producto para un mercado específico, confirma que está aprobado en tu país antes de comprarlo.
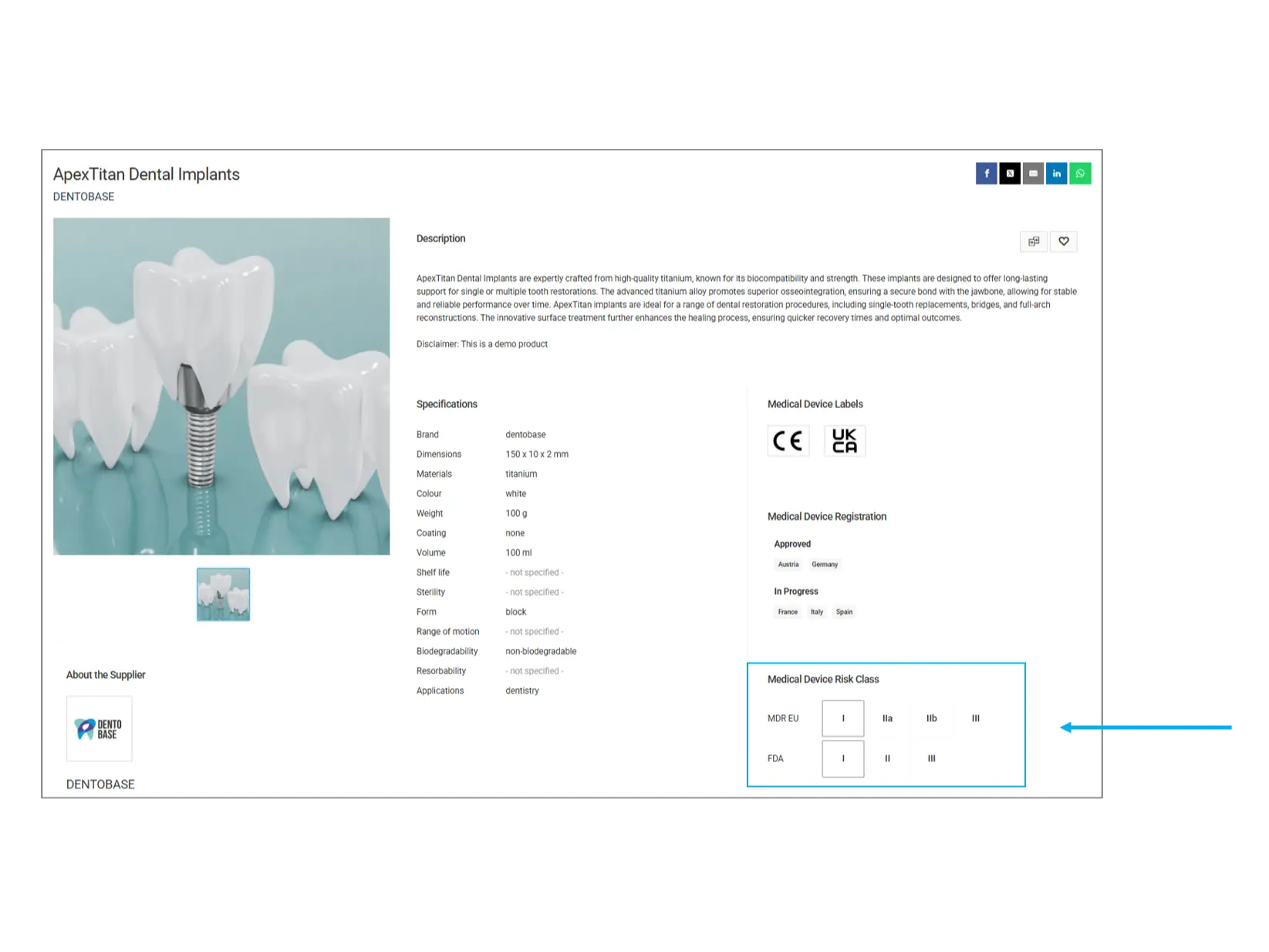
Clasificación de riesgo de dispositivos médicos
Los dispositivos médicos se clasifican en diferentes categorías de riesgo según su impacto potencial en la salud humana. Esta clasificación ayuda a comprender el nivel de regulación y los riesgos asociados con el producto.
MDR UE (Reglamento de Dispositivos Médicos - Unión Europea):
Clase I: Bajo riesgo (ej. vendajes, instrumentos dentales)
Clase IIa: Riesgo medio (ej. audífonos, equipos de diagnóstico por imagen)
Clase IIb: Mayor riesgo (ej. bombas de infusión, ventiladores)
Clase III: Alto riesgo (ej. marcapasos, válvulas cardíacas artificiales)
FDA (Administración de Alimentos y Medicamentos de EE.UU.):
Clase I: Controles generales (ej. depresores linguales, guantes quirúrgicos)
Clase II: Controles especiales (ej. tensiómetros, bombas de infusión)
Clase III: Requiere aprobación previa de mercado (ej. desfibriladores implantables, válvulas cardíacas)
¿Qué debes verificar? Los dispositivos de clases más altas están sujetos a regulaciones y pruebas más estrictas. Si tu aplicación requiere un producto altamente regulado, verifica que cumpla con la clasificación necesaria.
Is this article helpful?